专访阿斯利康全球研发中国中心总裁何静:希望以后把在中国的研发成果带到海外去
每经记者 郑洁 每经编辑 张海妮
第三届进博会于11月10日闭幕。此次进博会期间,英国药企阿斯利康可谓收获颇丰:两日签约交易额已近90亿元、阿斯利康位于上海的全球研发中国中心正式揭牌,阿斯利康还宣布与四川大学华西医院等全国22家医院签署战略合作框架备忘录。
关于这个研发中心的意义,阿斯利康表示在于“未来将从开展中国确证性研究支持新药上市工作向更早期研发扩展”。而据《每日经济新闻》记者了解,虽然与22家医院签约,但目前尚无具体项目敲定,阿斯利康期待的是能从长远促进新药临床研究和一些可能的转换。
图片来源于网络,如有侵权,请联系删除
相比以往,跨国药企越来越强调新药上市和本土创新,这其实是国内整个医疗生态转向的一个缩影。
“以前我们是‘global for China’,以后希望能把在中国的研发成果带到海外去。”在接受《每日经济新闻》记者(以下简称NBD)专访时,阿斯利康全球肿瘤研发高级副总裁、全球研发中国中心总裁何静博士表示,目前虽然有在一些PD-1/PD-L1热门靶点上研发扎堆的态势,但对近年来国内药政部门、药物研发的整体环境,她持相对乐观的态度,她相信,未来5到10年,国内的新药研发路径会从“me too”到“first in class”。
阿斯利康全球研发中国中心总裁何静。图片来源:受访者供图
跟医院签约 进一步促进临床研究和一些可能的转化
NBD:今年进博会上,对于研发部门来说最重要的日程是什么?
何静:在今年的进博会上,研发这块有两个非常重磅的议程,第一是阿斯利康全球研发中国中心的揭牌仪式;还有一个是我们和20多家医院签订战略合作备忘录,未来院方和阿斯利康能够开展更进一步的临床合作。
NBD:很多企业都提及了进博会的提振作用,您作为研发部门的领头人,这种提振能切实感受到吗?
何静:进博会上我们全球研发中国中心的揭牌,打开了一个窗口,让大家对阿斯利康中国整体的研发和创新能力有直观和深入的认识。阿斯利康的研发工作也经历了不同阶段,以前是global for China,但以后除了global for China外,我们在中国有一些研发和临床领域,希望能把国内的一类新药和研发成功经验带到国外去。
NBD:您刚才说到跟20多家医院签约是做研发,这一块可以多补充些信息吗?
何静:我们跟医院签署战略合作备忘录,其实主要目的是希望大家能不仅基于单个研究方案,而是从整体的疾病领域和临床实验方面进行长足合作。阿斯利康在一些重点的疾病领域布局长远。医院方面,从建设研究型医院的角度来说,也需要更多投入和提升。总体来说,我们作为申办方,医院作为临床研究中心,希望两个最重要的参与者能够共同把临床开发事业做得更好。
NBD:到目前为止有没有敲定或者说计划在这些医院开展哪些领域的研究?
何静:某种意义上,我们签订的是一个长远合作的方向,所以这个战略合作协议本身并不会规定某一个或者某几个临床研究,或者更详细的合作方案,等我们启动以后会再跟各方具体做进一步沟通。
NBD:您刚才说跟20多家医院签约,是为了促进创新和临床研究吗?
何静:主要是为了进一步促进临床研究和一些可能的转化。说到这里,我再多说两句:2019年一共新增300个左右肿瘤的临床研究,所以你可以想象得到,我们对于临床研究资源的需求是非常大的。
NBD:您具体是指临床研究资源的哪些方面?
何静:同时我们也看到,在去年300多个临床研究里,绝大部分研究项目被小部分的牵头的顶尖医院占据了,这反映出优质的临床资源仍然比较稀缺,整体分布也不均匀。
而从医院的角度看,现在医院都在提要建立科研型医院,这是一个很好的环境大势,希望大家一起把临床研究的生态系统建得更成熟。
肿瘤治疗领域 看好ADC和免疫疗法
NBD:今年6月,在欧洲血液学协会(EHA)第25届年会上,关于一个抗癌药物,阿斯利康公布了一组数据:单药一线治疗4年总缓解率(ORR)高达97%。请问这款BTK抑制剂在国内的临床试验目前是什么样的状态?
何静:您说的应该是我们AcalabrutinibBTK抑制剂,它确实不管在单药还是联合治疗,在套细胞淋巴瘤或慢性淋巴细胞性白血病上都能看到很好的结果,截至目前美国FDA已经批准了相关的两个适应症。
目前在中国,我们在不同的血液系统恶性肿瘤上都在开展不同阶段的临床研究,主要的适应症是套细胞淋巴瘤和慢性淋巴细胞性白血病,这是我们主要的两个在研方向。其他的(适应症)还有弥漫性大B细胞淋巴瘤,这些也是我们后续要开展临床研究的方向。
NBD:请问方便透露是临床实验的几期吗?
何静:在一期、二期、三期不同阶段的都有,同步进行当中。
另外我还想提一下,在中国已上市并在申请扩大适应症的药物,比如说泰瑞沙,前不久其研究试验提前两年揭盲,并在线发表于《新英格兰医学杂志》(NEJM.2020;383:1711),结果显示,对于EGFR突变阳性的ⅠB~ⅢA期非小细胞肺癌(NSCLC)术后患者,泰瑞沙作为辅助治疗可以显著延长无病生存期和中枢神经系统(CNS)无病生存期,这非常令人振奋。这个新适应症我们已经递交了NMPA,而且很高兴得到了优先审评的资格认定。
NBD:之前泰瑞沙上市,从进入绿色通道到正式审批是用了7个月的时间,它上市的速度很快。目前在阿斯利康肿瘤药的领域,除了泰瑞沙外,您有比较看好的进入临床末期的产品吗?
何静:处于临床实验末期的不得不提泰瑞沙,因为泰瑞沙还有一些其他方面的适应症还在继续研究中。还有现在大家都会提到的肿瘤免疫治疗,我们肿瘤免疫治疗药物英飞凡,在去年成为当时中国首个获批用于不可切除、三期非小细胞肿瘤肺癌患者治疗的PD-L1免疫抑制剂,该产品我们也在多个适应症方面开展研究。另外就是刚才跟您聊到的血液系统肿瘤的BTK抑制剂,我们也看到了它在国外的临床数据上有很好的结果。
此外,我们和日本第一三共制药共同开发两款抗体药物偶联物,也就是ADC,如果从肿瘤治疗临床开发的长远趋势来看,ADC肯定是另外一个重要的治疗方式。所以我们对这两款ADC寄予厚望,其中一个产品ENHERTU(DS-8201),在今年ASCO上,这个产品的一期临床研究,作为单药在包括乳腺癌、胃癌、肺癌等不同肿瘤方面,也看到了令人非常鼓舞的数据。
NBD:阿斯利康目前在研管线有90多个项目,您是怎样看待阿斯利康的研发管线和布局的?
何静:一方面我们有多年来很擅长的领域,比方说小分子药物的研发,以泰瑞沙为代表,包括其他几个小分子药物的开发,我们会继续深入研究,包括和细胞核特定信号传导通路相关的,包括和特定耐药机制相关的等等方面的研究。
另一方面,这几年我们也看到肿瘤的免疫治疗取得了长足进展,而且阿斯利康也在加快新治疗手段和方式的拓展。在早期管线布局中,我们有特异性双抗,包括我刚才跟您介绍的ADC抗体药物偶联物。不管是肿瘤还是非肿瘤,我们的宗旨是非常清楚的,就是以科学为导向,满足临床需求。
NBD:国内肿瘤治疗的临床研究和疗法,这么多年来,您觉得变化在哪里?您期待的肿瘤治疗的方向是什么样的?
何静:以我从业这些年的经验看,总体上我觉得我们的治疗理念还是非常紧跟欧美先进理念的,在美国获批的药物,在中国已经可以越来越快地上市和普及,这是第一点。
第二点,肿瘤治疗也是越来越进入到个体化治疗或者是精准治疗的时代,可能大家听到最多的一句话就是:肺癌不再是一种疾病。因为我们已经看到了,在肺癌领域其实也分了不同的亚型,不同的亚型对应不同的靶向治疗,会取得不同的效果。
所以在我看来,将来肿瘤治疗的趋势,仍然是在个体化治疗的道路上继续前进。比方说免疫治疗,并不是所有病人都能从免疫治疗中获得客观疗效,那我们怎样才能尽早筛查出能从免疫治疗里获益的病人?在我看来,不管在肿瘤研发和临床方面,能够给病人更精准并很有效的治疗,才是未来最重要的方向。
图片来源:摄图网
热门靶点研发扎堆 要注重差异化优势
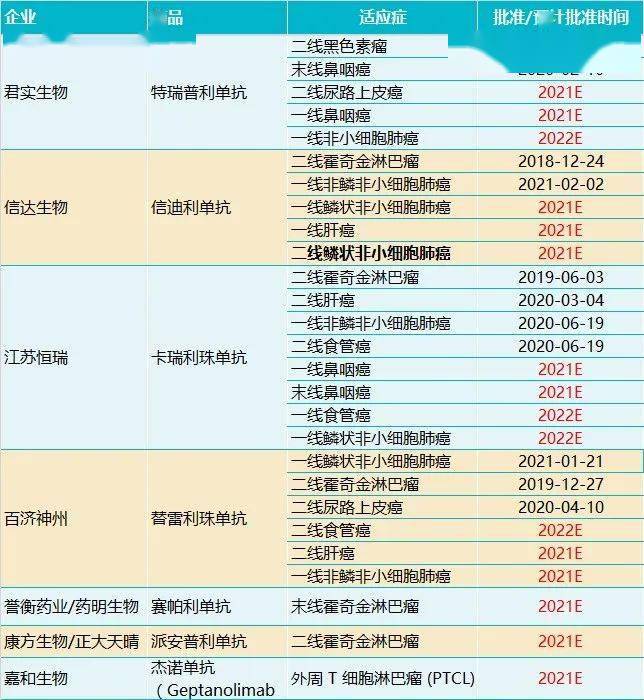
NBD:去年英飞凡作为国内首个PD-L1上市,今年在IVD赛道上无论国内还是国外企业,都是“人满为患”了,您怎么看待阿斯利康在PD-1/PD-L1上的布局?
何静:这是一个很热门的话题,不管是跨国药企还是国内药企,都已上市了多个PD-1/PD-L1,在研发扎堆的情况下,我认为产品的差异化优势非常重要。
英飞凡的第一个适应症是在肺癌的三期治疗阶段,这时病人不能接受根治性手术切除,能接受的是同步放化疗。英飞凡被证明在这个阶段对病人有很好的疗效,因此我们也会在相应的阶段去开展更多的探索,包括把在肺癌方面的成功经验向其他适应症拓展,比如局部晚期型食管癌。
NBD:您刚才说的PD-1/PD-L1是药研圈的“网红”,您现在怎么看待目前国内在这方面的研发现状?
何静:我觉得过去三四年的时间确实是在快速蓬勃发展的,这背后最大的推手是整个法规环境的改善,从国家政策方面促进创新,我们监管法规环境也体现出欢迎创新、拥抱创新的姿态。
当然相比美国目前临床开发的500多个靶点,中国的研发主要集中在100多个靶点上,某种程度上其实也反映了刚才我说的,多少有一些研发扎堆的情况,但是总体上看,我个人还是非常乐观积极地看待中国现在的本土创新。
过去几年,本土创新可能更多地考虑“me too”,现在不管是从分子结构或者说是从临床应用场景方面更多的是“me better”。我们也看到很多的“fast follower”,我觉得这也是让大家能够在短时间内提高整体创新能力的一个办法,不管监管当局还是药企都在适应新靶点不断出现的新常态。
过去药品多数是在FDA、在EMA已经批了的前提下再引进到中国,可是现在我们的药政部门更多在面对未获批的药品,甚至是全球最新的药品,这对于我们临床研究中心和研究者等都是很好的学习过程。虽然说我们现在的“first in class & best in class”的药品还是很有限,但是我相信在未来的5到10年,我们中国一定会出现这样的“first in class & best in class”。
要走到这一步,光靠临床研究阶段的推进是不行的,还需要基础研究的推进,包括国家对基础研究的投入,包括对基础研究系统性的培育,还有在基础研究中看到成果时,怎样把它转化成将来可能有临床价值的探索方向,以上环节都要逐渐连接起来。现在都在讨论源头创新,那只有真正源头创新了,中国才能有真正的“first in class”。
创新不能急功近利 科学和事实是最高宗旨
NBD:我们现在确实都在说源头创新,本土也有很多创新型药企,但难免还是在走“me too”路线。创新是必须的,但创新是很多药企都能具备的吗?
何静:我觉得创新的能力是企业必须具备的,但是大家不可能在同样的一个时间点都具备同样的创新能力,所以需要不断积累。但是从企业的长足发展来说,我想创新是根源。
NBD:对于药企来说研发能力非常重要,但研发本身需要非常大的投入,您作为研发部的领头人,您怎样看待这个问题的平衡。
何静:我觉得您说得很对,研发是需要长期的过程和投入,所以研发人员一定要有足够的耐心,不能抱着急功近利的想法,科学应该是最高宗旨。
我们做临床开发的目的,不只是为了拿到一个阳性的研究结果,而是为了拿到对病人有意义的、有临床指导价值的治疗方法。
研发也是需要时间的。虽然现在大家都在讲弯道超车,但我还是想说,如何实现差异化的研发策略,如何快速高效地执行研发方案,这才能实现所谓的“弯道超车”。而最重要的是,我们要尊重科学和事实。
NBD:您在国内国外都做过研发,对于现在国内医药政策改革,您有什么期待?
何静:如我刚才所说,总体上我们非常感谢国家政策的支持力度,比如过去几年新的药品管理办法不断出台,NMPA也越来越和国际先进的监管当局接轨。NMPA花了很大力气修订一些指导原则,过去这段时间里,我们能看到非常密集的指导原则和管理办法的改变,这些改变都在帮助企业更好地去实现创新。
现在政策法规已经比较全面了,最重要的,还是政策法规如何平稳落地和平稳过渡,另外在不同的政策制定层面,不同的国家部门如何更好地协调。在政策法规就绪后,如何平稳长期地落地和执行。
推荐阅读:
版权声明
本文仅代表作者观点,不代表xx立场。
本文系作者授权xx发表,未经许可,不得转载。
 财经瞭望网
财经瞭望网